Дофаминовые рецепторы головного мозга. Локализация и функции дофаминовых рецепторов. Прогрессия зависимости. Что будет, если злоупотреблять гормоном дофамином
На протяжении своей жизни первый человек почти никогда не будет страдать от неудовлетворенности собой, но и у него будет мало стимулов к личному развитию. Он будет доволен, если просто сыт, одет по погоде и т.д. Ему почти никогда не захочется что-то изменять к лучшему в себе или в жизни. Но этот человек для общества потребления не выгоден: его очень трудно заставить покупать что-то и менять что-то.
Второй человек обязательно будет чем-то недоволен. Он всегда может стремиться к тому, чтобы что-то исправить к лучшему, но это не будет приносить ему удовольствия. И вероятно, что такой человек будет искать сильные стимуляторы, чтобы выработать 40000 молекул дофамина, и у него высокий риск наркомании.
Второй важный момент связан не с приятными моментами, а с проблемами. Если первый человек облажается и у него упадет выработка дофамина (скажем на 20000 молекул), то он почувствует себя хуже на 50%. И это заставит его избегать неприятной ситуации в будущем, т.е. учится на ошибках. А вот у второго человека самочувствие снизится всего на 5%. Т.е. такого снижения явно недостаточно, чтобы он сделал выводы.
Германские нейробиологи предположили, что, возможно, недостаток дофаминовых рецепторов снижает способность людей учиться на собственных ошибках, то есть делать правильные выводы из негативного опыта и не повторять поступков, которые привели к дурным последствиям (Klein et al., 2007). В целом полученные результаты говорят о том, что нормальная работа дофаминовых систем головного мозга необходима для того, чтобы человек мог эффективно учиться на своих ошибках. Нарушение работы дофаминовых нейронов (например, из-за недостатка дофаминовых рецепторов, как у носителей аллеля A1) может приводить к игнорированию негативного опыта. Человек попросту перестает реагировать на отрицательные последствия своих поступков и поэтому может раз за разом наступать на те же грабли.
Есть несколько мутаций в генах рецепторов к дофамину. В случае зависимостей можно сдать анализ, для того, чтобы правильно выбрать тактику терапии для таких пациетов.
Мутация C2137T (Glu713Lys) в гене дофаминового рецептора 2-го типа, DRD2
Эта мутация связана с алкоголизмом, наркоманией, никотиновой зависимостью, игроманией. А1А1 генотип может привести к относительному сокращению числа DRD2 рецепторов, тем самым дополнительно ослабляя ответ на уже сниженные количества уровня дофамина. Сокращение D2 рецепторов дофамина, снижает чувствительность к последствиям негативного действия, этим можно объяснить повышенный риск развития аддиктивного поведения у носителей А1 аллельного варианта.
Проводились исследования, связанные с изучением связи генотипа по маркеру C2137T и обучения на основе обработки стимулов обратной связи – оценивалась способность людей учиться избегать действий с отрицательными последствиями. В группе носителей минорного (более редкого) аллеля А1 оно проходило менее эффективно, чем в группе носителей основного аллеля.
Есть еще и ген DRD4, ассоциированный со стремлением к новым впечатлениям. Длинный аллель этого гена с повышенной частотой встречается в семьях больных с наследственной формой алкоголизма, и он ассоциирован с «модным» детским диагнозом – синдром гиперактивности с нарушением внимания. Дети с таким диагнозом в школах не могут усидеть за партами. Любопытно, что это заболевание эффективно лечится без всяких таблеток на тренажерах с обратной связью. Детям показывают мультфильм на экране компьютера, и мультфильм выглядит резко, когда они внимательны. Внимательность фиксируется с помощью энцефалограмм, и в зависимости от внимательности детей изменяется резкость мультфильма.
У ученых, изучающих «синдром недостатка вознаграждения» (состояние, при котором «вознаграждающий центр мозга» активируется медленно), возникла интересная гипотеза о возможном значении низкой плотности рецепторов дофамина. Хорошо известно, что в нормальных условиях дофамин выделяется в синапс, связывается с рецепторами дофамина, вызывает эйфорию и снимает стресс. Синдром недостатка вознаграждения характеризуется снижением базального уровня дофамина из-за недостаточной мощности рецепторов, и это приводит к необходимости поиска человеком факторов, способных вызвать повышение уровня дофамина.
Если такое поведение длительно (наркомания), то оно перестараивает мозг и ухудшает ситуацию. Например, опыты с кокаином (который вызывает сильное выделение дофамина).
Действие кокаина было изучено на крысах. У крысы с сформированной кокаиновой зависимостью нейроны, опосредующие действие кокаина, имеют больше синапсов, чем у нормальных крыс. То есть, кокаин оказал на крыс такое же действие, как обучение. То есть, человек или крыса, которая пользовалась наркотиком, прошел «обучение», чтобы реагировать на наркотик, и у него сформировались патологические нервные связи, которые делают для него полученный опыт легко восстановимым, потому что нервные связи уже есть. А другие нервные связи, которые бы в норме обеспечивали ему приятные ощущения от полезных для здоровья переживаний, из-за конкурентного формирования оказываются ослабленными. То есть использование наркотиков, особенно в раннем возрасте, меняет морфологию и анатомию нейронов, структуру коры головного мозга, и уклоняет развитие с нормального пути.
Таким образом, внешнее повышение дофамина помогает кратковременно улучшить состояние, но притупит чувствительность дофаминовых рецепторов. Чем острее будет подъем дофамина, тем сильнее будет его падение после. При постоянных колебаниях дофамина, чувствительность к дофамину будет падать.
Вот поэтому у многих людей, часто облеченным властью или деньгами, развиваются шизоидное и садистское поведение. Для того, чтобы получить удовольствие, они вынуждены прибегать к гиперстимулам. Для людей с нормальными рецепторами эти гиперстимулы выглядят дико и отвратительно. В принципе, в основе шизофрении и лежит гиперстимуляция дофаминовых рецепторов.
Многие аспекты нашей жизни связаны с уровнем дофамина. Например, повышение социального статуса связано с плотностью рецепторов дофамина D2/D3 в полосатом теле – области мозга, отвечающей за вознаграждение, мотивацию и другие поведенческие процессы, в управлении которыми решающую роль играет именно дофамин. Результаты исследования показывают, что люди, достигшие более высокого социального статуса, придают большее значение вознаграждению и стимулированию, поскольку в их полосатом теле больше объектов, на которые воздействует дофамин. Обнаружено, что низкая плотность рецепторов дофамина была связана с низким социальным статусом, а высокая – соответственно, с более высоким социальным статусом. Похожая связь была выявлена, когда наши добровольцы рассказывали о поддержке, которую им оказывают друзья, родственники или кто-то, значимый для них.
Эти данные интересно освещают стремление к повышению социального статуса как основной социальный процесс. Звучит правдоподобно, что люди с более высоким уровнем рецепторов D2, то есть с более высокой мотивацией и вовлеченностью в общественные отношения, будут достигать больших успехов и более высокого уровня социальной поддержки.
Низкий уровень рецепторов D2/D3 может способствовать риску развития алкоголизма среди людей, чьи родственники уже злоупотребляют алкоголем. Люди с низкой плотностью рецепторов D2/D3 склонны иметь более низкий социальный статус и меньшую поддержку, а эти социальные факторы повышают риск того, что человек станет алкоголиком либо наркоманом.
Возможность самореализации тоже связана с дофаминовыми рецепторами. При отсутствии востребованности и возможности реализации индивидуальных возможностей сознания человек перестаёт получать удовлетворение, дофаминовые нейроны остаются «голодными», и у человека снижается настроение и уровень самооценки. Получается, что большое количество дофаминовых рецепторов может приводить к заниженной самооценке человека в силу нехватки дофамина за счёт возможности реализации индивидуальных возможностей сознания. При наличии большого количества дофаминовых рецепторов человек должен больше стремиться к познанию, развитию и возможности индивидуальной реализации, что будет всё более отражать разумность поведения. Поэтому для людей с высоким количеством дофаминовых нейронов скука и отсутствие возможности просто губительны.
Несколько советов, как восстановить чувствительность дофаминовых рецепторов и уровень дофамина. Заранее скажу, что это лишь общие советы, гарантии стопроцентного восстановления никто не даст. Советую сделать генетический тест, чтобы правильно оценить объем работы.
Дофаминовый протокол
1. Дофаминовый детокс
Убрать все внешние источники дофамина: лотереи, курение, наркотики, мастурбацию, кофе, шопинг. Убрать все «ложные» удовольствия, оставить только естественные потребности. Требуется время и терпение. Не отказывайтесь от всего сразу, делайте это постепенно.
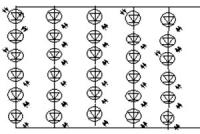
От зависимостей сложно избавится, но это первый шаг в возвращению вкуса жизни. Вы ведь знаете, что среди курильщиков на 40% больше депрессий. Вероятность депрессии у бывших курильщиков резко падает уже через несколько месяцев после прекращение курения. Посмотрите на картинку. Видите, как зависимости снижают уровень дофамина?
Уровень дофамина у здоровых людей и у курильщиков
Возьмём курение. Низкий уровень дофамина, который возникает в результате отказа от курения, на самом деле содействует возникновению рецидивов курения. Дофамин служит в качестве химического сигнала в процессах регуляции вознаграждения и мотивации. Последние исследования показывают, что одна из основных функций дофамина - посылать сигнал в мозг «искать что-то приятное». Действительно, дофамин выделяется в в процессе употребления наркотиков, курения, секса и приема пищи. Поскольку дофамин выделяется в ответ на курение, логично, что уровень дофамина выходит из нормы, когда курильщик хочет бросить курить. Ученые из Медицинского колледжа Бэйлора в Техасе провели исследование, чтобы охарактеризовать эти изменения. Они изучали мышей, которым вводили никотин, активный компонент сигарет, в течение нескольких недель. Затем исследователи отменяли никотин и измеряли последующие изменения в дофаминовой сигнализации мозга. Они сообщили, что отказ от никотина приводит к дефициту дофамина, который проходит при повторном воздействии никотина.
2. Низкострессовая монотонная среда
Уехать в скучное предсказуетмое место (или создать себе такое). Никаких новостей, фильмов. Сделайте ваш мини-монастырь.
У покорителя Арктики спросили: «Как Вы определяете время необходимости возврата полярной экспедиции?». На что покоритель Арктики довольно просто ответил: «У меня в экспедиции присутствует всего одна женщина. При наборе людей в экспедицию я выбираю самую некрасивую женщину, которую встречу. И если уже в период экспедиции, мне эта женщина покажется красавицей, то значит пришло время возврашаться на большую землю».
3. Культивируйте скромность, занимайтесь монотонными однообразными делами
Навык делать маленькие дела, задумывая и осуществляя их. Посадить клумбу, вбить гвоздь. Для реабилитации не планируйте дел, занимающих больше двух часов. Затем, со временем, можно наращивать их продолжительность. Ритмичные монотонные действия помогают стабилизировать перепады нейромедиаторов.
4. Техники осознанности
Принятие негативных эмоций без закручивания негативной спирали. Обучение выдерживать чувства.
5. Техника присутствия в настоящем моменте
Избегать фантазий о прошлом или будущем. Поток дофамина может возрастать уже при одном воспоминании о поощрении. Уже одно размышление о позитивном опыте уже может быть небольшим поощрением. Все мы любим помечтать об интересных для нас вещах чтобы поднять себе настроение. Даже если это мысли о негативном, то возможно удовольствие доставляет представление даже того как человек уходит от погони, побеждает врага, решает мировые проблемы или справляется с личными трудностями (поэтому мы любим боевики, например). Однако некоторые люди злоупотребляют этим методом, умышленно перенапрягают эту систему поощрения, и искусственно вызывая интересные для них воспоминания и мысли снова и снова, поскольку таким образом натурально производятся нейромедиаторы хорошего настроения (дофамин и серотонин), теряя при этом самоконтроль.
Следует учитывать следующие факторы влияющие на уровень дофамина:
- Работа со страхом смерти (для людей без суицидального риска)
- Когнитивная терапия и когнитивное совершенствование личности (работа над собой и своими поступками) по принципу простых алгоритмов и ежедневного анализа, вроде ведения дневников: подумал, оценил, отреагировал, почему, какие еще варианты
- Качественный сон. Недостаток сна приводит к резкому уменьшению рецепторов дофамина! Но это никак не было связано с изменениями уровня нейромедиатора
6. Составление списка «настоящих радостей». Составить и следовать сети мелких радостей

7. Ориентироваться в повседневной жизни на процесс, а не результат
Личности, которые однажды сфокусировавшись на возможности получить удовлетворение от чего-либо, уже не могут перестроить свое поведение до тех пор, пока не добьются своего. Тяга к удовольствию «перекрывает» всякий здравый смысл.
Дофаминовые рецепторы
Вначале дофаминовые рецепторы подразделялись на два класса: D1 и D2. В дальнейшем было клонировано пять подтипов дофаминовых рецепторов, которые входят в эти два класса D1-подобные дофаминовые рецепторы включают D1 и D5 подтипы, а D2-подобные дофаминовые рецепторы включают D2, D3 и D4 подтипы. Дофаминовые рецепторы посредством G-белков связаны с аденилатциклазой (стимуляция D1-рецепторов активирует аденилатциклазу, а D2-рецепторов - угаетает).
D1-подобные дофаминовые рецепторы (подтипы D1 и D5) участвуют в процессах постсинаптического торможения. Большинство нейролептиков блокирует D1-рецепторы, но выраженность этого эффекта не коррелирует с их антипсихотической активностью. Так, например, бутерофеноны являются сильными нейролептиками, но слабыми антагонистами D1-рецепторов.
D2-подобные дофаминовые рецепторы (подтипы D2, D3 и D4) участвуют в процессах пресинаптического и постсинаптического торможения. Большинство известных эффектов дофамина связано с активацией D2-рецепторов. Выраженность антипсихотической активности нейролептиков прямо пропорциональна их сродству к D2-рецепторам. Этот факт свидетельствует о том, что развитие шизофрении связано с активацией D2-рецепторов центральных дофаминергических путей. D2-pецепторы (а также D3 и D4) в основном находятся в лимбической системе, которая отвечает за формирование настроения и эмоций. В области хвостатого ядра имеется большое количество D2-рецепторов, которые получают волокна от нигростриатного дофаминергического пути. Нейролептики блокируют эти рецепторы, поэтому часто вызывают двигательные нарушения. Участвуют ли D3-рецепторы в реализации антипсихотического эффекта нейролептиков наравне с D2-рецепторами, неизвестно. Азалептин имеет высокое сродство к D4-рецепторам и слабое к D2-рецепторам.
Механизм действия нейролептиков. Каким образом нейролептики уменьшают продуктивную симптоматику шизофрении, неизвестно. Так как все антипсихотические средства являются антагонистами дофаминовых рецепторов, предполагают, что развитие шизофрении связано с повышенной активностью ме-золимбических и мезокортикальных дофаминергических путей. Однако убедительных доказательств изменений дофаминергической системы при шизофрении нет.Химическое строение
Антипсихотические средства имеют различную химическую структуру, однако все они блокируют дофаминовые рецепторы.
Фенотиазины подразделяются в зависимости от строения боковой цепи, присоединённой к атому азота фенотиазинового кольца, на следующие группы:
1) алифатические производные (содержат пропиламиновую боковую цепь). Алифатические производные фенотиазина обладают относительно слабой антипсихотической активностью и вызывают много побочных эффектов (показаны на рисунке). Аминазин (хлорпромазин) был первым фенотиазином, достаточно широко применяемым при шизофрении, несмотря на выраженные побочные эффекты. Препарат оказывает сильный седативный эффект, он особенно эффективен при психомоторном возбуждении. Аминазин может вызвать реакции повышенной чувствительности в виде агранулоцитоза, гемолитической анемии, кожной сыпи, холестатической желтухи, фотосенсибилизации;
2) пиперидиновые производные (содержат в боковой цепи ядро пиперидина). Основным препаратом этой группы является тиоридазин (меллерил, сонапакс). Препарат эффективен у пациентов пожилого возраста, не вызывает сонливости, обладает выраженной антихолинергической активностью, двигательные нарушения при его применении возникают реже, чем при использовании других нейролептиков. Тиоридазин может вызвать сексуальные расстройства (в том числе нарушения эякуляции), иногда (при использовании в высоких дозах) - дегенерацию сетчатки;
3) пиперазиновые производные (содержат в боковой цепи ядро пиперазина). К этой группе относятся: фторфеназин (флуфеназин, модитен), этаперазин (перфеназин) и трифтазин (трифлуоперазин). Седативное и антихолинергическое действие препаратов этой группы менее выражено, чем у аминазина. Однако при их применении возможно появление двигательных расстройств, особенно у пожилых пациентов.Нейролептики другой химической структуры
Бутерофеноны. Галоперидол оказывает слабое антихолинергическое действие, слабее аминазина угнетает ЦНС и снижает артериальное давление. Однако при его применении часто наблюдаются двигательные нарушения.
Атипичные нейролептики (азалептин, рисперидон, тиоридазин, сульпирид). Эти препараты называются «атипичными», так как они редко вызывают двигательные нарушения. Азалептин (клозапин) является единственным истинным атипичным нейролептиком, потому что он практически не вызывает экстрапирамидных расстройств и эффективен при резистентности к лечению другими антипсихотическими средствами. Препарат может вызвать нейтропению (3% пациентов) и агранулоцитоз (1% пациентов), поэтому его применяют в основном при неэффективности других антипсихотических средств. В процессе лечения азалептином необходимо тщательно следить за картиной крови. Азалептин в терапевтических дозах блокирует в основном D4-рецепторы (находящиеся преимущественно в лимбической системе), оказывая слабое влияние на D2-рецепторы стриапаллидарной системы. Вместе с тем азалептин блокирует м-холинорецепторы и 5-НТ2-рецепторы. Возможно, что атипичное действие азалептина связано с его м-холиноблокирующей активностью, так как антихолинергические средства уменьшают выраженность двигательных нарушений, вызванных применением нейролептиков. Однако тиоридазин, также оказывающий м-холиноблокирующее действие, может вызвать экстрапирамидные расстройства. Существует предположение, что атипичные свойства азалептина связаны с блокадой 5-НТ2-рецепторов. Однако этому положению противоречит тот факт, что антагонист 5-НТ2-рецепторов ритансерин не устраняет галлюцинации и бред. Рисперидон - это новое антипсихотическое средство без седативного эффекта, оказывающее слабое антихолинергическое и сс-адреноблокирующее действие. Рисперидон является антагонистом 5-НТ2-рецепторов и D2-рецепторов (более сильным, чем азалептин). При использовании в малых дозах не вызывает экстрапирамидных расстройств (однако при применении в высоких дозах двигательные нарушения могут появляться). Сульпирид является антагонистом D2-рецепторов, оказывает седативное действие, обычно хорошо переносится пациентами. Препарат широко используют при шизофрении, так как он редко вызывает экстрапирамидные нарушения, возможно, это связано с тем, что сульпирид имеет большее сродство к мезолимбическим D2-рецепторам, чем к стриатным D2-рецепторам.Депо-препараты
(препараты пролонгированного действия)Число пациентов с шизофренией в настоящее время неуклонно возрастает, что требует создания препаратов пролонгированного действия (депо-препаратов) для поддерживающей терапии. Масляные растворы галоперидола деканоата, фторфеназин-деканоата (модитен-депо, флуфеназина деканоат) флупентиксола деканоата применяют внутримышечно с интервалами в 1-4 недели, однако использование этих препаратов увеличивает частоту возникновения двигательных расстройств.
Дофамин – биогенный амин, образующийся из l-тирозина и являющийся предшественником норадреналина и адреналина и медиатором, взаимодействующим с?– и?-адренорецепторами, а также со специфическими рецепторами, получившими название дофаминовых и расположенных в различных областях организма. Много дофаминовых рецепторов в различных областях ЦНС. Их можно разделить на пресинаптические и постсинаптические.
Многие группы фармакологических веществ действуют на дофаминергическую систему, которая включает нигростриатные, мезолимбические и тубероинфундибулярные пути. От состояния дофаминергической системы зависят центральная регуляция двигательной активности, поведенческие и психические функции, продукция ряда гипофизарных гормонов (секреция пролактина, гормона роста), функция центра рвоты. Регуляция дофаминергической системы осуществляется через разные типы дофаминовых (D) пост- и пресинаптических рецепторов. Стимуляция пресинаптических дофаминовых рецепторов уменьшает синтез и высвобождение из нервных окончаний дофамина.
Выделяют 2 группы дофаминовых рецепторов: группа D1-рецепторов (подгруппы D1 и D5) в основном вызывает постсинаптическое торможение. Они связаны с 08-белками. Стимулируют аденилатциклазу, повышая содержание цАМФ. Группа D2-рецепторов (подгруппы D2, D3 и D4) вызывает пре- и постсинаптическое торможение. Эти рецепторы связаны с Gi/o-белками. Ингибируют аденилатциклазу. Кроме того, они активируют К+-каналы и оказывают угнетающее действие на Са2+-каналы. Из применяемых лекарственных средств известны как блокаторы дофаминовых рецепторов (например, антипсихотические и некоторые противорвотные средства), так и вещества, активирующие дофаминергическую систему (ряд противопаркинсонических средств; дофаминомиметик бромокриптин, угнетающий при акромегалии1 продукцию гормона роста и пролактина)
Дофамин (допмин) действует на дофаминовые рецепторы, а также, являясь предшественником норадреналина, опосредованно стимулирует α- и β-адреноцепторы. В средних терапевтических дозах дофамин оказывает положительное инотропное действие (за счет стимуляции β1-адренорецепторов сердца), которое сочетается с расширением почечных и мезентериальных сосудов (возбуждает дофаминовые рецепторы гладких мышц). Применяется дофамин при кардиогенном шоке. Препарат может вызывать тахикардию, аритмию, чрезмерное повышение периферического сопротивления сосудов и работы сердца.
Противосудорожные средства. Противоэпилептические средства. Классификация и особенности применения лекарственных средств при разных формах припадков, противопоказания, побочные эффекты.
Противоэпилептические средства применяют для предупреждения или уменьшения судорог или соответствующих им эквивалентов (потеря или нарушение сознания,)наблюдаемых при периодически возникающих приступах различных форм эпилепсии.
Механизм действия таких препаратов не совсем ясен, так как в большинстве случаев неизвестна этиология эпилепсии. По-видимому, одна из возможностей заключается в снижении веществами возбудимости нейронов эпилептогенного очага. Однако, у многих противоэпилептических средств преобладает их угнетающее влияние на распространение патологической импульсации.
Угнетение противоэпилептическими веществами межнейронной передачи возбуждения может быть связано как с подавлением процесса возбуждения нейронов, так и с усилением тормозных влияний, в том числе обусловленных стимуляцией тормозных нейронов.
Существует несколько судорожных и бессудорожных форм эпилепсии, каждая из которых характеризуется своеобразной клинической картиной и определенными изменениями на ЭЭГ. Так, выделяют большие судорожные припадки, малые приступы эпилепсии, миоклонус-эпилепсию3, фокальную (парциальную) эпилепсию4 и др.
Лечение каждой из форм эпилепсии проводят определенными противоэпилептическими средствами.
К противоэпилептическим средствам предъявляется ряд требований. Прежде всего эти средства должны обладать высокой активностью и большой продолжительностью действия. Хорошая всасываемость из ЖКТ- одно из необходимых свойств таких препаратов. Желательно, чтобы они были эффективны при разных формах эпилепсии, что особенно важно при лечении смешанных ее форм. Седативный, снотворный и другие побочные эффекты неаллергической и аллергической природы крайне нежелательны, так как такие вещества принимают регулярно в течение многих месяцев и лет. При их использовании не должны возникать кумуляция, привыкание и лекарственная зависимость. малая токсичность и большая широта терапевтического действия. современные противоэпилептические средства отвечают лишь некоторым из этих требований.
Классифицируют противоэпилептические средства, обычно исходя из их применения при определенных формах эпилепсии:
I. Генерализованные формы эпилепсии
Большие судорожные припадки (grand mal; тонико-клонические судороги)
Натрия вальпроат Ламотриджин Дифенин Топирамат
Карбамазепин Фенобарбитал Гексамидин
Эпилептический статус
Диазепам Клоназепам Дифенин-натрий
Лоразепам Фенобарбитал-натрий Средства для наркоза
Малые приступы эпилепсии (petit mal; absense epilepsia) Этосуксимид Клоназепам Триметин
Натрия вальпроат Ламотриджин Миоклонус-эпилепсия
Клоназепам Натрия вальпроат Ламотриджин
II. Фокальные (парциальные) формы эпилепсии
Карбамазепин Ламотриджин Клоназепам Тиагабин
Натрия вальпроат Фенобарбитал Топирамат Вигабатрин
Дифенин Гексамидин Габапентин
Основные лекарственные средства для предупреждения больших судорожных припадков эпилепсии - карбамазепин, дифенин, натрия вальпроат, фенобарбитал, ламотриджин.
Фенобарбитал (люминал) является производным барбитуровой кислоты. Оказывает выраженное снотворное действиЕ. Механизм действия фенобарбитала заключается в активации ГАМК-ергической системы. Активность фенобарбитала при эпилепсии связана, с его угнетающим влиянием на возбудимость нейронов эпилептогенного очага, а также на распространение нервных импульсов. Может наблюдаться седативное, а иногда и снотворное действие препарата. При длительном его применении не исключена возможность развития привыкания и лекарственной зависимости.
Более избирательным противоэпилептическим эффектом обладает производное гидантоина дифенин. Он блокирует Na-каналы, пролонгирует время их инактивации и тем самым препятствует генерации и распространению высокочастотных разрядов. Последнее предупреждает развитие судорог.
Из ЖКТ дифенин всасывается хорошо.Продукты превращения дифенина и незначительная его часть в неизмененном виде выделяются из организма почками. Дифенин может кумулировать, но в значительно меньшей степени, чем фенобарбитал.
В отличие от фенобарбитала общего угнетающего действия на ЦНС дифенин не оказывает. При применении дифенина могут наблюдаться нарушения нейрогенного происхождения (головокружение, атаксия, тремор и др.). Нередко отмечается гиперпластический гингивит, может вызывать тошноту и рвоту. Возможны разнообразные кожные высыпания.
Дофаминергическая теория патогенеза шизофрении пользовалась популярностью на протяжении последней четверти ХХ века. Представляется значимым познакомить читателя с основными положениями современного учения о дофамине.
Дофамин является не только предшественником норадреналина, но и сам выступает в роле трансмиттера. Локализация дофамина в нервной системе отличается от локализации других катехоламинов: норадреналина и адреналина.
Богатая сеть чувствительных к дофамину рецепторов выявлена во многих структурах центральной нервной системы.
Вся обширная зона срединного возвышения занята дофаминергическими терминалями, и только единичные окончания нервных клеток этой области чувствительны к норадреналину.
Нейроны, чувствительные к дофамину, в основном сконцентрированы в следующих структурах: черной субстанции, вентральной покрышке, полосатом теле, обонятельной луковице, гипоталамусе (аркуатное ядро), вокруг желудочков продолговатого мозга (перивентрикулярная область) и сетчатке.
Аксоны нейронов, чувствительных к дофамину, проецируются в лобную кору (окончания рецепторов, чувствительных к дофамину в коре мозга встречаются довольно редко), лимбическую систему, неостриатум, срединное возвышение.
Таблица 10. Роль дофаминергических трактов в патогенезе симптомов шизофрении
Дофаминергические нейроны перивентрикулярного и аркуатного ядер медиобазального гипоталамуса (А14 и А12) осуществляют транспорт дофамина в гипофиз.
Прилежащее ядро и некоторые другие подкорковые структуры лимбической системы также имеют отношение к некоторым проявлениям шизофрении, вероятно, определенную роль здесь играет и особенность связи между нейронами вентрального поля покрышки среднего мозга с базальными ганглиями.
Известна гетерогенность дофаминовых рецепторов. В настоящее время выделено, клонировано и охарактеризовано с помощью молекулярнобиологических, биохимических и фармакологических методов 5 подтипов рецепторов дофамина (D1-D5), различающихся по характеристикам связывания с различными агонистами и антагонистами, а также по системе трансдукции сигнала.
Все подтипы рецепторов дофамина сгруппированы в два семейства: D1-подобные (D1 и D5) и D2-подобные (D2, D3, D4).
Классификация рецепторов дофамина
D1-подобные
- D1 (нейроны нигростриатной и мезокортиколимбической системы, миндалины)
- D5 (периферические отделы нервной системы)
D2-подобные
- D2 (стриатум, лимбические структуры мозга: черная субстанция, вентральная тегментальная область, гиппокамп)
- D3 (стриатум, включая прилежащее ядро)
Более изучены D1 и D2 рецепторы дофамина, которые, впрочем, как и другие рецепторы дофамина, представляют собой одноцепочные полипептиды, включающие в себя от 387 до 475 аминокислотных остатков.
D1 и D2 рецепторы дофамина экспрессированы и имеют больше селективных агонистов и антагонистов по сравнению с другими подтипами дофаминовых рецепторов.
Установлено, что рецепторы D1-типа, сопряженные с Gs-белком, активируют аденилатциклазу. Активация D1-D5 рецепторов приводит к повышению уровня внутриклеточного цАМФ.
Геномная структура рецепторов дофамина зависит от принадлежности к тому или иному семейству рецепторов. Гены D1-подтипа не имеют интронов, в то время, как D2, D3, D4 - имеют соответственно 6, 5 и 3 интрона. Присутствие интронов позволяет образовывать различные изоформы с помощью альтернативного плайсинга.
Дофаминовые рецепторы D1 (стимулируются аденилатциклазой) локализованы в основном в нейронах нигростриатной и мезокортиколимбической систем, миндалине. При этом они встречаются в мозге нормального человека реже, чем D2.
D1-рецепторы подавляются лишь относительно высокими (микромолярными) концентрациями антагонистов, например, нейролептика галоперидола.
Дофаминовый рецептор D2, преобладающий в мозге здорового человека, по сравнению с другими рецепторами, чувствительными к дофамину, обнаруживает, наиболее высокое сродство ко многим антипсихотическим веществам. По данным некоторых исследований, проведенных с помощью позитронно-эмиссионной томографии, он имеет наибольшую плотность в стриатуме и лимбических структурах мозга.
Высокая концентрация рецепторов этого типа определяется в черной субстанции, вентральной тегментальной областях и гиппокампе.
При обследовании префронтальной коры каких-либо значимых отличий в плотности D2-рецепторов не было найдено.
Активация D2-рецепторов приводит к снижению уровня внутриклеточного цАМФ (циклический аденозинмонофосфат).
Плотность рецепторов D1 и D2-типа заметно выше, чем D3 и D4, кроме того, рецепторы первых типов выявлены в большем количестве структур мозга.
Дофаминовые рецепторы D3 и D4 имеют более ограниченное распределение в мозге человека, причем рецептор D3 изучен наиболее подробно. Экспрессия D3-рецепторов характерна для вентрикулярного стриатума, включая прилежащее ядро. У больных шизофренией здесь обнаружено повышение плотности рецепторов типа D3 с относительным накоплением «усеченных форм» рецепторного белка, образующихся при аномальном плайсинге. D3, D4-рецепторы зависят от сигнальной системы цАМФ.
Рецепторы D5-типа выявлены главным образом в периферических отделах нервной системы.
Согласно дофаминовой гипотезе развития шизофрении, многие симптомы этого заболевания возникают из-за усиления активности дофаминергических путей передачи информации , усиления активности дофамина, особенно в мезолимбических структурах, или повышения чувствительности рецепторов этого медиатора.
Вследствие активации дофаминергической системы появляются структурно-функциональные нарушения в тех областях мозга, которые иннервируются этой системой, особое значение при этом придается дезорганизации функционирования префронтальной коры (Tamminga C., 2006).
Эту гипотезу подтверждают экспериментальные психозы, амфетаминовый психоз, результаты исследований, посвященных антипсихотикам, обнаружение большого числа числа рецепторов дофамина при некоторых постмортальных исследованиях мозга больных шизофренией.
Аналог дофамина - алкалоид растительного происхождения мескалин способен вызывать галлюцинации, подобные тем, которые отмечаются при шизофрении. Предшественник дофамина - диоксифенилаланин, основа которого применяется при паркинсонизме, также может спровоцировать появление симптомов, напоминающих проявления шизофрении.
При шизофрении отмечается усиление активности (избыток) дофамина в мезолимбических структурах мозга (предположительно отвечающих за позитивную симптоматику, например, галлюцинации) и ее снижение (дефицит) в мезокортикальных структурах, префронтальном кортексе (возможно, отвечающих за негативные симптомы и когнитивные расстройства).
Префронтальная кора, и особенно дорзальная латеральная ее часть, вероятно, напрямую связана с проявлениями шизофрении. Поражение этой области приводит к функциональным проявлениям, аналогичным негативным симптомам шизофрении.
Эволюция дофаминергической теории патогенеза шизофрении сместила акцент с медиаторной на рецепторную компоненту дофаминовой системы.
С усовершенствованием методов нейровизуализации появилась возможность непосредственно определять связывающие параметры рецепторов и рецепторные мишени психофармакологических препаратов.
Информативный подход к оценке активности дофаминергической системы при шизофрении основан на использовании лигандов, избирательно взаимодействующих с D2-рецепторами и позволяющих определить их способность к связыванию.
Сравнивая количество занятых рецепторов до и после введения препарата, можно оценить соотношение высвобождения и обратного захвата дофамина (Энн С., Койл Дж., 2007). Оказалось, что D2-рецепторы после взаимодействия с лигандом тормозят аденилатциклазу, опосредуя свое действие через Gi-белки. Рецепторы D2 подавляются низкими концентрациями антагонистов, при этом происходит функциональное снижение активности дофамина.
В современных работах, посвященных патогенезу шизофрении, большое внимание уделяется анализу плотности и соотношению разных видов дофаминергических рецепторов.
Многие исследователи полагают, что изменение соотношения между разными типами рецепторов, чувствительных к дофамину, лежит в основе патогенеза шизофрении. Подавление функций D1 и D2-рецепторов приводит к нарушению различных форм стереотипной двигательной активности. Несбалансированное усиление функций рецепторов, чувствительных к дофамину (в основном D2-типа), вероятно, также играет большую роль в патогенезе шизофрении.
В дорсолатеральной префронтальной коре, в частности, ответственной за рабочую память и исполнительные функции, преобладают дофаминовые рецепторы D1-типа. Отметим, что активность коры мозга сказывается на выделении дофамина в полосатом теле, и напротив, усиление дофаминергической иррадиации в кору со стороны подкорковых структур приводит к обострению продуктивной симптоматики шизофрении.
В литературе сведения, касающиеся роли D1-рецепторов при шизофрении, крайне противоречивы.
По мнению большинства исследователей, D 1-рецепторы не повреждены при шизофрении , однако в некоторых работах отмечено снижение их плотности (возможно и D2) в коре лобных долей . Эти изменения особенно заметны при выраженной негативной симптоматике. В контексте с вышесказанным напомним о снижении дофаминергической активности между мезокортикальным отделом и префронтальной корой. Отсюда можно сделать вывод, что назначение таких нейролептиков, как галоперидол, вследствие блокады D1-рецепторов приводит к усилению негативной симптоматики и, возможно, когнитивному дефициту.
Отдельные исследователи указывают, что при изменении плотности D 1 -рецепторов в префронтальной коре мозга фиксируется ухудшение рабочей памяти .
Снижение плотности D1-рецепторов в коре лобных долей
- Негативная симптоматика
- Когнитивные нарушения
Увеличение плотности D2-рецепторов в лимбической системе
- Позитивная симптоматика
Результаты некоторых исследований позволяют сделать вывод, что плотность D2-рецепторов у больных шизофренией почти на 10% повышена по сравнению с лицами контрольной группы.
Авторадиографически (позитронно-эмиссионная томография - РЕТ) обнаружены отличия в экспрессии D2-рецепторов в супрагранулярном и гранулярном слоях височной коры мозга больных шизофренией, увеличение количества дофаминергических нейронов в лимбической системе. Однако другие исследования не подтвердили данный факт.
Гиперактивность D2-рецепторов или повышенная дофаминергическая активность в подкорковых структурах мозга, точнее в мезолимбической системе, по мнению большинства исследователей, является одним из основных звеньев патогенеза позитивной симптоматики при шизофрении. Блокада D2-рецепторов приводит к ослаблению выраженности последней.
Изучение мозга больных шизофренией после их смерти выявило повышение плотности рецепторов D 2- типа в различных структурах, причем наиболее выраженные изменения обнаружены в левой миндалине , входящей в состав лимбической системы, и височной доле . Однако, в связи с тем что нейроны после смерти распадаются, истинную концентрацию дофамина в тканях мозга определить практически невозможно.
Методы прижизненной нейровизуализации (РЕТ, СПЕКТ), нацеленные на исследование дофаминергических процессов, происходящих при шизофрении в полосатом теле, продемонстрировали, что акцент исследований следует пренести с постсинаптических D2-рецепторов на пресинаптические. Именно на этих рецепторах большинство исследователей обнаружило существенные изменения (Карлссон А., Лекрубье И., 2004).
При шизофрении обнаружено увеличение числа рецепторов дофамина в хвостатом ядре, а в стриатуме в 4-5 раз возрастает количество и плотность рецепторов типа D 4 , который в норме обнаруживается в данной структуре лишь в небольших количествах.
Дофаминовый рецептор D4 имеет наибольшую плотность в лимбической коре мозга и обладает повышенным сродством к клозапину (рецептор D4 контролируется геном, расположенным на 11-й хромосоме-полиморфный участок p15.5). Исходя из вышесказанного, можно предположить, что при шизофрении активируются минорные типы рецепторов дофамина.
Длительное время было неясно, за счет чего увеличивается количество дофаминовых рецепторов при шизофрении. Обусловлен ли данный факт самим процессом болезни или является результатом лечения психотропными средствами. В последнее время получены достаточно убедительные данные, свидетельствующие о том, что увеличение количества дофаминовых рецепторов при шизофрении не является следствием фармакотерапии психотропными средствами.
Установлена высокая активность системы, чувствительной к дофамину к гормональным воздействиям. Показана модификация постсинаптических рецепторов дофамина женскими половыми гормонами (эстрогенами и прогестероном). Недостаток этих гормонов снижает, а избыток, напротив, усиливает ответ дофаминовых рецепторов на взаимодействие с лигандом.
Дофаминергическая гиперактивность в большей степени объясняет развитие позитивной симптоматики, в то время как возникновение негативных симптомов некоторые исследователи связывают с гипофункцией системы дофамина. (Сarpenter W., Buchanan R., 1994).
К агонистам дофаминовых рецепторов-средствам, активирующим дофаминергическую систему, относятся: апоморфин , перголид, бромокриптин , хинаголид, каберголин, аминотетралин, 2-амино-6,7-1,2,3,4-тетрагидронафтален (АДТН), амфетамин, метилфенидат, кокаин . Злоупотребление этими веществами может спровоцировать психоз, в клинической картине которого выражена продуктивная симптоматика, в частности, параноидный синдром. Кроме того, прием психостимуляторов может вызвать рецидив шизофрении.
Агонисты дофаминовых рецепторов
- Апоморфин
- Бромокриптин
- Каберголин
- Амфетамин
- Метилфенидат
- Кокаин
- L-допа
В литературе, посвященной дофаминовой теории патогенеза шизофрении, можно встретить высказывания о том, что прием амфетамина провоцирует значительно большее выделение дофамина у больных шизофренией, чем у здоровых людей. «Амфетаминовый эффект» проявляет себя более ярко во время обострения продуктивной психотической симптоматики.
Некоторые исследователи обнаружили определенную связь между некоторыми проявлениями негативной симптоматики (аффективное уплощение) и снижением дофаминергической передачи в полосатом теле. Однако следует отметить, что такие признаки негативной симптоматики, как абулия - ангедония, и такие когнитивные расстройства, как нарушение внимания, не коррелируют с индексом плотности D2-рецепторов.
Взаимосвязь активности дофаминергической системы мозга с продуктивной и негативной симптоматикой шизофрении представлена в таблице 11.
Некоторые исследователи полагают, что при шизофрении дофаминовые рецепторы сверхчувствительны (сверхактивны), но уровень дофамина в тканях мозга при этом не повышен.
Таблица 11. Взаимосвязь позитивной и негативной симптоматики шизофрении с уровнем активности дофаминергической системы мозга
|
Позитивная симптоматика |
Негативная симптоматика |
|
Усиление активности дофаминергических нейронов в лимбических структурах мозга |
Ослабление активности дофаминергических нейронов в префронтальной коре мозга |
|
Усиление активности дофаминергических нейронов в зоне Брока, в верхней височной извилине (слуховые галлюцинации) |
Снижение дофаминергической активности в передней цингулярной извилине (дефицит внимания, расстройство мышления) |
|
Увеличение числа рецепторов дофамина D2 и D4 |
Нормальное или сниженное количества рецепторов дофамина D2 |
|
Низкая активность МАО тромбоцитов |
Высокая активность МАО тромбоцитов |
|
Усиление активности нейронов гиппокампа |
Ослабление активности нейронов гиппокампа |
|
Изменения на нейрохимическом уровне выражены более заметно, чем на структурном уровне |
Изменения скорее структурного, чем функционального (нейрохимического) плана |
Введение предшественника дофамина-ДОФА или отмеченных выше веществ, усиливающих высвобождение медиатора из пресинаптических окончаний (амфетамин), т.е. повышающих уровень нейромедиатора, может вызвать состояние близкое к клинической картине шизофрении.
Вначале развивается психомоторное возбуждение, а затем наблюдаются монотонные стереотипные движения. Растительный аналог дофамина мескалин (триметоксифенилаланин) вызывает галлюцинации, напоминающие галлюцинации при шизофрении. Известно, что в настоящее время не найдено фармакологических агентов, реагирующих специфически по отношению к различным изоформам D2-рецепторов.
Интересно отметить, что ряд агонистов дофаминовых рецепторов способен ослаблять выраженность негативной симптоматики при шизофрении, в то время как антагонисты, напротив, усиливают ее. Этот факт может свидетельствовать о противоположной направленности звеньев патогенеза позитивной и негативной симптоматики шизофрении. Однако возможно, что при шизофрении повышение активности дофаминергической системы в передней поясной коре и других лимбических структурах мозга приводит к возникновению позитивной симптоматики, в то время как негативная симптоматика появляется в результате снижения активности дофаминергических нейронов в префронтальной коре мозга. Поэтому препараты для лечения шизофрении должны усиливать активность дофаминергической системы в префронтальной коре мозга, но ослаблять ее активность в лимбических структурах.
Обладающие способностью ингибировать дофаминергические рецепторы, нашли широкое применение при лечении шизофрении.
Многие антипсихотики имеют структурное сходство с молекулой дофамина, поэтому они влияют на постсинаптические рецепторы этого медиатора и могут блокировать их.
К наиболее известным антагонистам дофаминовых рецепторов типа D2 можно отнести: галоперидол, спироперидол, производные фенотиазина (хлорпромазин, перфеназин), клозапин, сульпирид.
Эти вещества могут вызывать экстрапирамидные расстройства, генез которых связывают с блокадой дофаминовых рецепторов, т.е. снижением их активности, аналогично эффекту при болезни Паркинсона, симптоматика которой включает в себя экстрапирамидные нарушения и где отмечается гибель или ослабление активности дофаминергических нейронов.
Отметим, что в результате приема атипичных антипсихотиков рецепторы D2 блокируются дифференцировано. У некоторых препаратов, например, клозапина, происходит блокада D2-рецепторов в темпоральном кортексе (амигдал, гиппокамп), при этом здесь обнаруживается сродство средней выраженности. Рисперидон демонстрирует более высокое сродство к D2-рецепторам, расположенным в лимбической системе.
В мозге больных шизофренией отмечается выраженное снижение активности МАО - основного фермента, окисляющего катехоламины, что, в свою очередь, может быть причиной накопления медиаторов, в частности дофамина.
Если у здорового человека описаны четыре изоформы МАО (1, 11 - альфа, 11 - бета, 111), то при шизофрении не обнаружено формы 111 и существенно модифицированы другие формы.
Наряду с общим уменьшением активности МАО при шизофрении установлено значительное усиление метаболизма катехоламинов по минорному хиноидному пути (в норме по хиноидному пути окисляется не более 5% катехоламинов). Интересно отметить, что эти реакции характерны для мышечной ткани, а не для тканей мозга. После индолизации и нескольких окислительно-восстановительных реакций образуется ряд биологически активных соединений, эффекты которых отличаются от эффектов обычных медиаторов. Так, в частности, образуется адренохром («вещество страха»), накопление которого в тканях мозга вызывает чувство страха и адренолютин, снимающий эти ощущения.
Несмотря на многочисленные данные, свидетельствующие о важной роли дофамина в генезе шизофрении, в правомерности этой гипотезы заставляет сомневаться ряд фактов. Приведем здесь лишь некоторые из них.
Улучшение состояния больных шизофренией начинается значительно позднее, чем блокада рецепторов дофамина, т.е. клинический эффект расходится с фармакологическим механизмом действия препаратов. Антипсихотики не всегда оказывают влияние на симптоматику шизофрении даже при значительной (свыше 90%) блокаде рецепторов дофамина и могут ее редуцировать при незначительной блокаде, как, например, в случае клозапина, блокирующего всего лишь 20-60% рецепторов типа D2.
По мнению некоторых психиатров, действие антипсихотиков связано с блокадой D2-рецепторов, но данный эффект опосредованно запускает изменение в других системах нейротрансмиттеров.
Известно, что нейроны чувствительные к дофамину модулируют активность других нейротрансмиттеров, например, ГАМК-эргическую активность префронтальной коры, с другой стороны, нейроны, чувствительные к серотонину, влияют на активность нейронов мезолимбической системы, чувствительных к дофамину.
Отметим, что клиническую эффективность некоторых современных антипсихотиков, в большей степени связывают с влиянием на рецепторы , чем дофамина.
При шизофрении не удалось обнаружить первичный дефект дофаминергической трансмиссии, в связи с тем что при функциональной оценке дофаминергической системы исследователи получали различные результаты.
Попытки прижизненного определения уровня дофамина и его метаболита-гомованилиной кислоты в плазме крови, моче и цереброспинальной жидкости также дали противоречивые результаты, вероятно, вследствие большого объема биологических сред, нивелирующих те изменения, которые могут быть отражением дисфункцией дофаминергической системы при шизофрении.
В литературе встречается информация, опровергающая наличие усиления метаболизма дофамина при шизофрении. Отмечается, что в настоящее время нет убедительных доказательств общей гиперактивности дофаминергической системы при шизофрении. На это указывает и тот факт, что дискинезия, которая может отражать усиление дофаминергической активности, при шизофрении встречается редко.
Дофами́н - нейромедиатор, центральной нервной системы, а также медиатор нервной локальной (паракринной) регуляции в ряде периферических органов (в том числе слизистой желудочно-кишечного тракта, почках). Также гормон, вырабатываемый мозговым веществом надпочечников и другими тканями (например, почками), но в подкорку мозга из крови этот гормон почти не проникает. По химической структуре дофамин относят к катехоламинам. Дофамин является биохимическим предшественником норадреналина и адреналина в ходе их синтеза.





Норадреналин Адреналин
История
Дофамин был впервые синтезирован в 1910 году, но многие годы он считался лишь предшественником адреналина и норадреналина. Только в 1958 году шведский ученый Арвид Карлссон обнаружил, что дофамин является важнейшим нейротрансмиттером в мозге. Более чем через 40 лет, в 2000 году, за это открытие ему была присуждена Нобелевская премия по физиологии и медицине.



Лабораторная крыса в специальном ящике нажимает рычаг. К голове животного прикреплены стимуляторы.
В фундаментальном исследовании 1954 года канадские учёные Джеймс Олдс и его коллега Питер Милнер обнаружили, что если имплантировать электроды в определённые участки мозга, особенно в средний узел переднего мозга, то крысу можно приучить нажимать рычаг в клетке, включающий стимуляцию низковольтными разрядами электричества. Когда крысы научились стимулировать этот участок, они нажимали рычаг до тысячи раз в час. Это дало основание предположить, что стимулируется центр наслаждения. Один из главных путей передачи нервных импульсов в этом участке мозга - дофаминовый, поэтому исследователи выдвинули версию, что главное химическое вещество, связанное с удовольствием, - это дофамин. В дальнейшем это предположение было подтверждено радионуклидными томографическими сканерами и открытием антипсихотиков (лекарственных средств, подавляющих продуктивные симптомы шизофрении).
Однако в 1997 году было показано, что дофамин играет более тонкую роль. В эксперименте Шульца у обезьяны создавали условный рефлекс по классической схеме Павлова: после светового сигнала в рот обезьяне впрыскивали сок.
Результаты позволили предположить, что дофамин участвует в формировании и закреплении условных рефлексов при положительном подкреплении и в гашении их, если подкрепление прекращается. Другими словами, если наше ожидание награды оправдывается, мозг сообщает нам об этом выработкой дофамина. Если же награда не воспоследовала, снижение уровня дофамина сигнализирует, что модель разошлась с реальностью. В дальнейших работах показано, что активность дофаминовых нейронов хорошо описывается известной моделью обучения автоматов: действиям, быстрее приводящим к получению награды, приписывается большая ценность. Таким образом происходит обучение методом проб и ошибок.
Нейромедиатор
Дофамин является одним из химических факторов внутреннего подкрепления (ФВП) и служит важной частью «системы вознаграждения» мозга, поскольку вызывает чувство удовольствия (или удовлетворения), чем влияет на процессы мотивации и обучения. Дофамин естественным образом вырабатывается в больших количествах во время положительного, по субъективному представлению человека, опыта - к примеру, приёма вкусной пищи, приятных телесных ощущений, а также наркотиков. Нейробиологические эксперименты показали, что даже воспоминания о поощрении могут увеличить уровень дофамина, поэтому данный нейромедиатор используется мозгом для оценки и мотивации, закрепляя важные для выживания и продолжения рода действия.
Дофамин играет немаловажную роль в обеспечении когнитивной деятельности. Активация дофаминергической передачи необходима при процессах переключения внимания человека с одного этапа когнитивной деятельности на другой. Таким образом, недостаточность дофаминергической передачи приводит к повышенной инертности больного, которая клинически проявляется замедленностью когнитивных процессов (брадифрения) и персеверациями. Данные нарушения являются наиболее типичными когнитивными симптомами болезней с дофаминергической недостаточностью - например, болезни Паркинсона.
Как и у большинства нейромедиаторов, у дофамина существуют синтетические аналоги, а также стимуляторы его выделения в мозге. В частности, многие наркотики увеличивают выработку и высвобождение дофамина в мозге в 5-10 раз, что позволяет людям, которые их употребляют, получать чувство удовольствия искусственным образом. Так, амфетамин напрямую стимулирует выброс дофамина, воздействуя на механизм его транспортировки.

Другие наркотики, например, кокаин и некоторые другие психостимуляторы, блокируют естественные механизмы обратного захвата дофамина, увеличивая его концентрацию в синаптическом пространстве.

Морфий и никотин имитируют действие натуральных нейромедиаторов, а алкоголь блокирует действие антагонистов дофамина. Если пациент продолжает перестимулировать свою «систему поощрения», постепенно мозг адаптируется к искусственно повышаемому уровню дофамина, производя меньше гормона и снижая количество рецепторов в «системе поощрения», один из факторов побуждающих наркомана увеличивать дозу для получения прежнего эффекта. Дальнейшее развитие химической толерантности может постепенно привести к метаболическим нарушениям в головном мозге, а в долговременной перспективе потенциально нанести серьёзный ущерб здоровью мозга
Для лечения болезни Паркинсона часто используют агонисты дофаминовых рецепторов (то есть аналоги дофамина: прамипексол, бромокриптин, перголид и др.): на сегодняшний день это самая многочисленная группа противопаркинсонических средств. Некоторые из антидепрессантов также обладают дофаминергической активностью.


Существуют и лекарственные препараты, блокирующие дофаминергическую передачу, например такие антипсихотические средства, как аминазин, галоперидол, рисперидон, клозапин и др. Резерпин блокирует накачку дофамина в пресинаптические везикулы.



При таких психических заболеваниях, как шизофрения и обсессивно-компульсивное расстройство ((от лат. obsessio - «осада», «охватывание», лат. obsessio - «одержимость идеей» и лат. compello - «принуждаю», лат. compulsio - «принуждение») (ОКР , невро́з навя́зчивых состоя́ний ) - психическое расстройство. Может иметь хронический, прогрессирующий или эпизодический характер.), отмечается повышенная дофаминергическая активность в некоторых структурах мозга, в частности в лимбическом пути (при шизофрении отмечается вдобавок пониженная активность дофамина в мезокортикальном дофаминовом пути и префронтальной коре), а паркинсонизм связан с пониженным содержанием дофамина в нигростриарном пути. Со снижением уровня дофамина в подкорковых образованиях и передних отделах головного мозга связывают также процесс нормального старения.
Гормон
Дофамин обладает рядом физиологических свойств, характерных для адренергических веществ.
Дофамин вызывает повышение сопротивления периферических сосудов. Он повышает систолическое артериальное давление в результате стимуляции α-адренорецепторов. Также дофамин увеличивает силу сердечных сокращений в результате стимуляции β-адренорецепторов. Частота сердечных сокращений увеличивается, но не так сильно, как под влиянием адреналина.
В результате специфического связывания с дофаминовыми рецепторами почек дофамин уменьшает сопротивление почечных сосудов, увеличивает в них кровоток и почечную фильтрацию, повышается натрийурез. Происходит также расширение мезентериальных сосудов. Этим действием на почечные и мезентериальные сосуды дофамин отличается от других катехоламинов (норадреналина, адреналина и др.). Однако в больших концентрациях дофамин может вызывать сужение почечных сосудов.
Дофамин ингибирует также синтез альдостерона в коре надпочечников, понижает секрецию ренина почками, повышает секрецию простагландинов тканью почек.
Дофамин тормозит перистальтику желудка и кишечника, вызывает расслабление нижнего пищеводного сфинктера и усиливает желудочно-пищеводный и дуодено-желудочный рефлюкс. В ЦНС дофамин стимулирует хеморецепторы триггерной зоны и рвотного центра и тем самым принимает участие в осуществлении акта рвоты.
Через гематоэнцефалический барьер дофамин мало проникает, и повышение уровня дофамина в плазме крови оказывает малое влияние на функции ЦНС, за исключением действия на находящиеся вне гематоэнцефалического барьера участки, такие как триггерная зона.
Повышение уровня дофамина в плазме крови происходит при шоке, травмах, ожогах, кровопотерях, стрессовых состояниях, при различных болевых синдромах, тревоге, страхе, стрессе. Дофамин играет роль в адаптации организма к стрессовым ситуациям, травмам, кровопотерям и др.
Также уровень дофамина в крови повышается при ухудшении кровоснабжения почек или при повышенном содержании ионов натрия, а также ангиотензина илиальдостерона в плазме крови. По-видимому, это происходит вследствие повышения синтеза дофамина из ДОФА в ткани почек при их ишемии или при воздействииангиотензина и альдостерона. Вероятно, этот физиологический механизм служит для коррекции ишемии почек и для противодействия гиперальдостеронемии и гипернатриемии.